腹 膜 假 性 黏 液 瘤 互 助 联 盟
China Pseudomyxoma Peritonei (PMP) Patient Support Group

自助 助人 温暖 希望
本文收录: 许洪斌,蔡莺. 腹膜假黏液瘤典型病案分析[M]. 2021年11月 第一版.北京:科学出版社, 2021:14—22
(一) 概述
腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy, HIPEC)是一种新兴的腹腔恶性肿瘤辅助治疗手段。最早由Spratt在1980年报道[1] ,近年来随着HIPEC技术 方法及设备的不断创新改进,HIPEC已经作为恶性肿瘤辅助治疗手段广泛应用于腹腔恶性肿瘤的腹膜种植转移及其并发的恶性腹水[2-7]。《腹腔热灌注化疗技术临床应用专家共识》(2016版)对HIPEC技术的基本概念及应用解析有完整的阐述,本章部分内容摘自该共识[8]。
(二) 基本原理
HIPEC兼具热疗和化疗双重治疗作用,可清除腹腔内微小转移灶、游离癌细胞和亚临床病灶[9-10]。热疗通过利用肿瘤细胞和正常组织细胞不可逆损害的临界温度不同[11],从而选择性杀伤肿瘤细胞。此外热疗与化疗具有协同作用,热疗能增加化疗药物的细胞毒作用,加大化疗药物在组织间的渗透作用,从而更高效地杀伤肿瘤细胞[12-16]。有研究报道,43℃时,热疗与化疗药物的协同作用可表现为药物的渗透深度由2mm增至5mm[17]。
HIPEC通过建立腹腔与外界的持续循环,用含化疗药物的灌注液持续冲刷腹腔,从而清除腹腔内游离癌细胞、亚临床病灶和腹膜微小转移灶。
HIPEC在腹膜种植转移中广泛应用的原因:由于腹膜血浆屏障的存在,单纯的全身静脉化疗药物浓度难以达到有效抑制癌细胞生长所需浓度,但HIPEC是腹腔直接给药,可以增加化疗药物与腹膜及腹腔内游离癌细胞接触的概率,从而更好地杀伤肿瘤细胞。有研究报道,腹腔内给药的化疗药物浓度水平要比血浆水平高20~1000倍[18]。
(三) 适应证
HIPEC治疗适应证:①胃癌、结直肠癌、胆管癌、胰腺癌、卵巢癌、子宫内膜癌; ②腹膜假性黏液瘤;③腹膜恶性间皮瘤;④癌性腹水;⑤其他恶性肿瘤腹膜种植转移的研究性治疗。HIPEC预防适应证:①进展期胃癌、结直肠癌、卵巢癌根治手术后预防腹膜种植转移;②进展期胆管癌、胰腺癌根治手术后的研究性治疗。
(四) 禁忌证
①各种原因所致腹腔内广泛粘连者;②吻合口存在水肿、缺血、张力等愈合不良因素者;③肠梗阻患者;④有明显肝肾功能不全者;⑤严重心血管系统病变者;⑥生命体征不稳定者;⑦恶病质患者。
(五) 灌注药物
H1PEC灌注药物选择需要考虑的因素:①针对原发疾病治疗有效;②腹膜吸收率低、 腹膜刺激性小和腹腔肿瘤穿透力较强;③在43℃时与热疗有协同作用;④以往治疗方案敏感药物。临床上常选择的化疗药物包括丝裂霉素、顺铂、卡铂、奥沙利铂、紫杉醇、吡柔比星和吉西他滨。
给药方式既可选择单一给药又可联合序贯给药,给药剂量一般参照静脉用药酌情加减。 需要注意的是若联合静脉化疗,腹腔给药剂量应酌减;若应用对腹膜、胸膜通透性不高的药物,可适当增加剂量从而提高局部药物浓度达到更佳的细胞减灭效果。此外,选用铂类药物时要做好水化,应用紫杉醇时要抗过敏,以确保治疗过程的安全性。
《腹腔热灌注化疗技术临床应用专家共识》(2016版)推荐的针对具体疾病进行 HIPEC治疗的药物:①胃癌,选择紫杉醇、多西他赛、奥沙利铂、顺铂和表柔比星;②结直肠癌,选择奥沙利铂、顺铂和丝裂霉素;③妇科肿瘤,选择紫杉醇、多西他赛、奥沙利铂、卡铂、顺铂和表柔比星;④腹膜假性黏液瘤,选择奥沙利铂、卡铂、顺铂、丝裂霉素和表柔比星;⑤肝胆胰腺癌,选择紫杉醇、多西他赛、奥沙利铂、卡铂、顺铂、丝裂霉素、表柔比星和吉西他滨。
(六) 治疗时机
总的来说,术中灌注的疗效优于术后灌注,术中灌注的优势:①术中灌注是在充分减瘤即瘤负荷最低的情况下进行;②CRS分离了腹腔粘连,充分地显露了腹膜表面,能更好地使含化疗药物的灌注液均匀分布于腹腔;③术后腹腔粘连造成患者对灌注的不耐受。建议术后HIPEC要尽早开始,有相关理论研究结果显示,残留癌细胞在术后24小时发生增殖动力学变化,G。期癌细胞进入增殖期,3天后增殖速度减缓,1周后恢复到术前水平[19]。
最常采用的灌注模式为术中灌注+术后早期连续灌注,即术中行CRS之后行热灌注一次,术后24小时开始第一次术后热灌注化疗,连续进行5次。
对于以大量腹水为主要症状的腹膜疾病患者,可采取腹腔镜下穿刺置管,根据疾病种类选择化疗药物,行术后连续HIPEC,笔者所在中心有少量此种病例,此方案对控制腹水有一定效果,需要注意的是,HIPEC主要作用在残留癌细胞和微小癌结节,对长径<12.5px 的肿瘤效果好,对长径>50px的肿瘤需要先行CRS,然后行HIPEC。
HIPEC作为肿瘤辅助治疗方式,常需要联合其他治疗方式,最常见的是CRS+HIPEC 的治疗方式,此疗法综合了手术、局域化疗、热疗和液体机械冲刷作用,是目前治疗腹膜恶性肿瘤最有效的治疗方式。CRS最大限度地清除了肉眼可见肿瘤,HIPEC进一步消除或缩小CRS后残留的癌细胞、微小癌结节。两者相辅相成,可达到最佳治疗效果。
(七) 具体操作方式
按照《腹腔热灌注化疗技术临床应用专家共识》(2016版),HIPEC循环通路的建立过程:在完成CRS后于腹壁4个象限各放置1条灌注管,两侧入水口导管位于脐上4~125px 与锁骨中线相交处,两侧出水导管位于脐下4~125px与锁骨中线相交处,在无菌条件下将管路与外循环管及体腔热灌注治疗仪连接,构成循环通路。
黏液瘤患者的循环通路建立过程:CRS结束后进行,分别于左、右膈下各置导管1根, 盆底置导管2根,导管戳孔引出体外,关闭腹腔。盆腔作为入水管,左、右膈下管作为出水管。灌注管连接腹腔热灌注治疗系统,选择恒温、恒速的灌注系统。笔者所在中心的各项HIPEC参数设定(图4-1):①灌注液为生理盐水或5%葡萄糖溶液+化疗药物,灌注液量为3000~6000ml,根据患者腹腔的容量大小选择,一般术后灌注液量参照术中灌注液量减量,总的原则是腹腔充盈但张力不影响心率和呼吸,且循环通畅,化疗药物要根据原发肿瘤选择敏感药物,剂量参照静脉化疗;②设置入体温度为43.0~43.5℃;③灌注流速为400~600ml/min;④灌注治疗时间为60~90分钟,根据不同药物来选择,一般来说,术后均选择60分钟;⑤灌注间隔时间,术中与术后第一次灌注间隔24~48小时,术后每次间隔24小时;⑥灌注次数,以腹膜假黏液瘤为例,术中1次,术后5次,共 6次。
 图4-1 HIPEC实施中各项参数设定
图4-1 HIPEC实施中各项参数设定
(八)腹腔灌注过程中镇静镇痛药物的应用
按照《腹腔热灌注化疗技术临床应用专家共识》(2016版),在进行HIPEC治疗时应给予镇静药,根据患者反应调整镇静药的剂量,根据生命体征监测情况进行补液,要使用监护仪进行监护。
常用药物为盐酸异丙嗪(非那根)25mg和(或)曲马朵100mg(或者地佐辛 5mg), 一般情况下肌内注射给药即可,特殊情况时可根据患者情况调整剂量或静脉给药。丙泊酚首次静脉注射1~2mg/kg,之后维持剂量2mg/(kg • h ),该药只有麻醉医师或重症监护室医师有权限使用。
(九)腹腔灌注过程中可能出现的不良反应及处理
HIPEC实施过程中需要一名医师和护士配合工作,灌注管路与人体管路连接过程一定要遵守无菌原则,灌注全程应进行生命体征监护(图4-2)及灌注管路通畅性监测。由于灌注液高于体温,患者出现心率加快或血压升高属于正常改变,但心率升高幅度超过患者基础心率20%应排除血容量不足、活动性出血等因素,及时给予相应处理。呼吸和血氧饱和度的改变应综合灌注液量对胸腔压迫和麻醉药物等因素,必要时需及时终止治疗,给予相应处理。灌注液颜色的变化亦要密切关注,如出现灌注液颜色进行性加深,同时出现呼吸、心率增快,应急查血常规,根据患者手术情况明确有无活动性出血,必要时需及时终止治疗,给予相应处理。灌注后早期的低热可能与灌注液高于体温有关,可先观察,恶心、呕吐及腹胀腹痛可能与灌注过程灌注液充盈腹腔有关,可给予止吐、解痉、镇痛等对症处理。化疗药物对应的不良反应如骨髓抑制应密切监测并给予相应处理。有部分病例出现胃肠道功能恢复延迟,与本身疾病手术及灌注有关,经对症处理后均恢复正常。
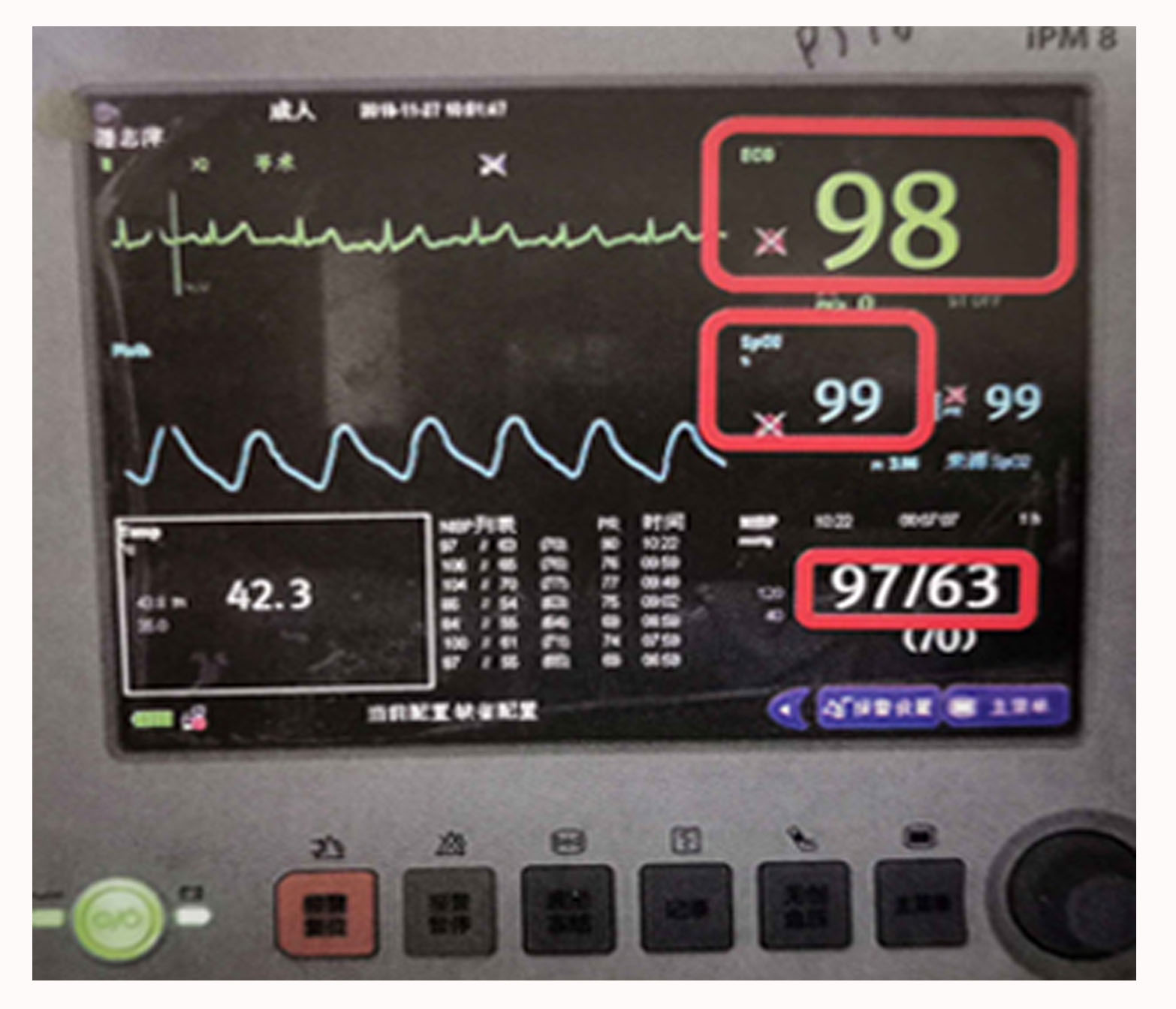 图4-2生命体征监测
图4-2生命体征监测
(十)疗效评价
①相关肿瘤标志物检测,以腹膜假黏液瘤为例,治疗后检测CEA、CA125、CA19-9. CA153、CA242、CA72-4,并与术前相比较、评估;②影像学检查,如B超、CT、MRI、 PET/CT等,与术前及术后早期进行比较;③KPS评分或ECOG评分;④无进展生存率和 总生存率;⑤WHO肿瘤临床疗效评价标准。
(十一)HIPEC治疗情况及相关研究
作为PMP规范治疗的重要手段,笔者所在科从2008年即开始实施HIPEC,至2019年共完成HIPEC达2000例次,作为腹膜假黏液瘤辅助治疗方式得到广泛开展。笔者所在科多应用丝裂霉素C( MMC )、氟尿嘧啶、顺铂等进行HIPEC,其中MMC应用于术中, 一般剂量为10mg;氟尿嘧啶多应用于术后,剂量为650mg/m2;对存在明显腹水的患者应用顺铂,总剂量不超过80mg,可一次性给予或分次给予。用药剂量总的原则是参照静脉给药剂量,同时也要给予相应的预处理(参照药物应用于静脉化疗时给予的预处理),具体实例将在病例分享中详细介绍。
目前笔者所在中心正开展保持治疗过程中温度恒定性的研究,通常是在行CRS结束后, 放置测温管于肠间隙,在围手术期的HIPEC治疗过程中对深部温度实时掌控,真正做到HIPEC治疗过程中的“恒温”(图4-3~图4-7)。
 图4-3 灌注初始时温度,肠间隙温度36.9T;机器示出体温度41.7℃
图4-3 灌注初始时温度,肠间隙温度36.9T;机器示出体温度41.7℃
 图4-4 灌注开始2分钟温度,肠间隙温度39.1℃;出体后到达机器时温度40.3℃
图4-4 灌注开始2分钟温度,肠间隙温度39.1℃;出体后到达机器时温度40.3℃
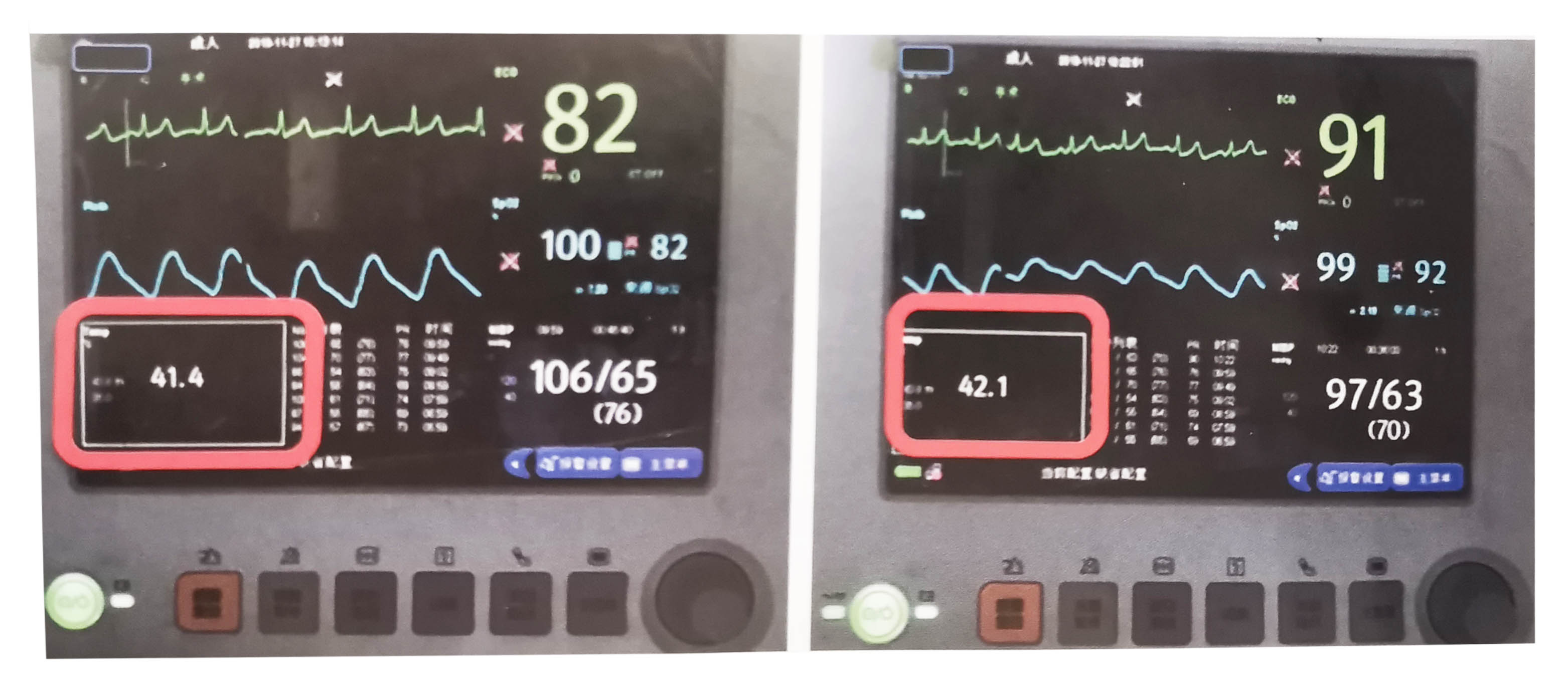 图4-5灌注开始后5分钟时肠间隙温度41.4℃;灌注开始后15分钟时肠间隙温度42.1℃
图4-5灌注开始后5分钟时肠间隙温度41.4℃;灌注开始后15分钟时肠间隙温度42.1℃
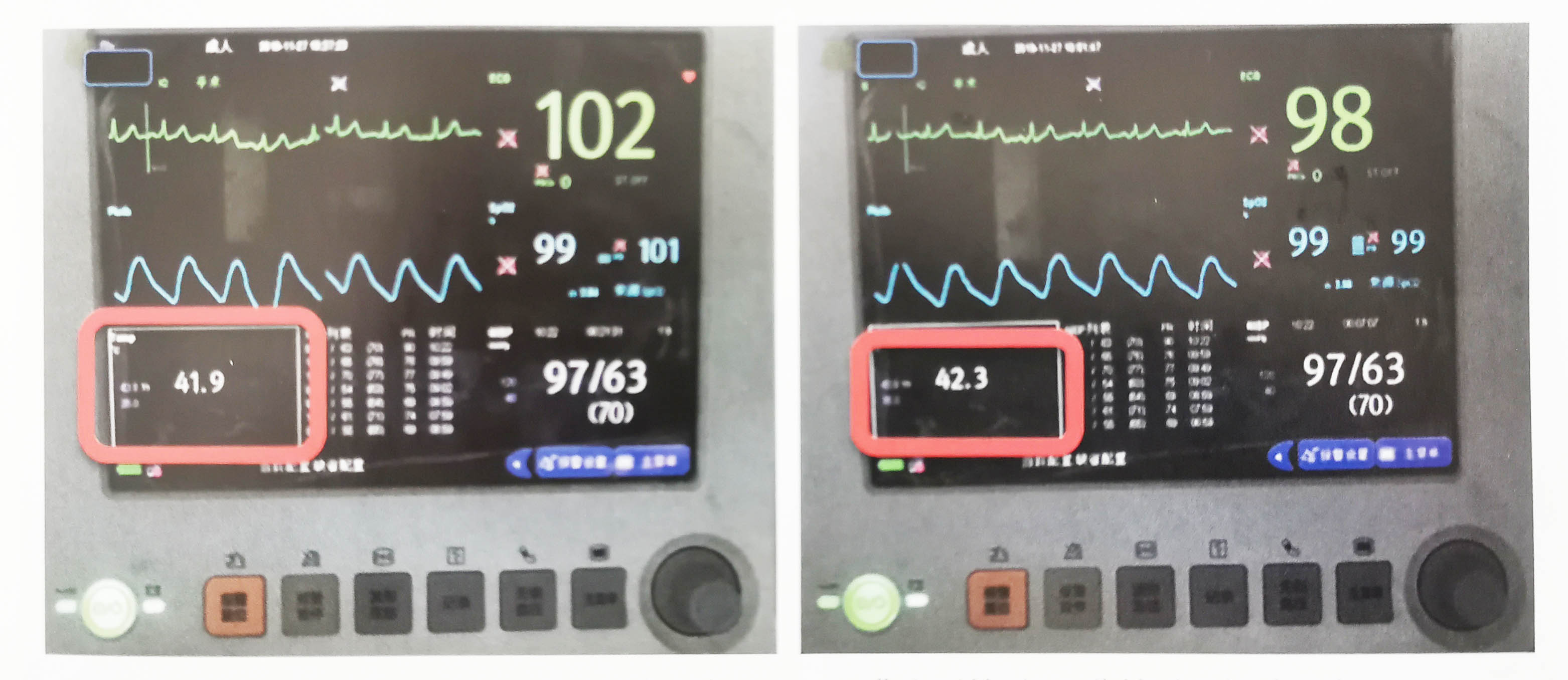
图4.6灌注开始后30分钟时肠间隙温度41.9℃;灌注开始后45分钟时肠间隙温度42.3℃
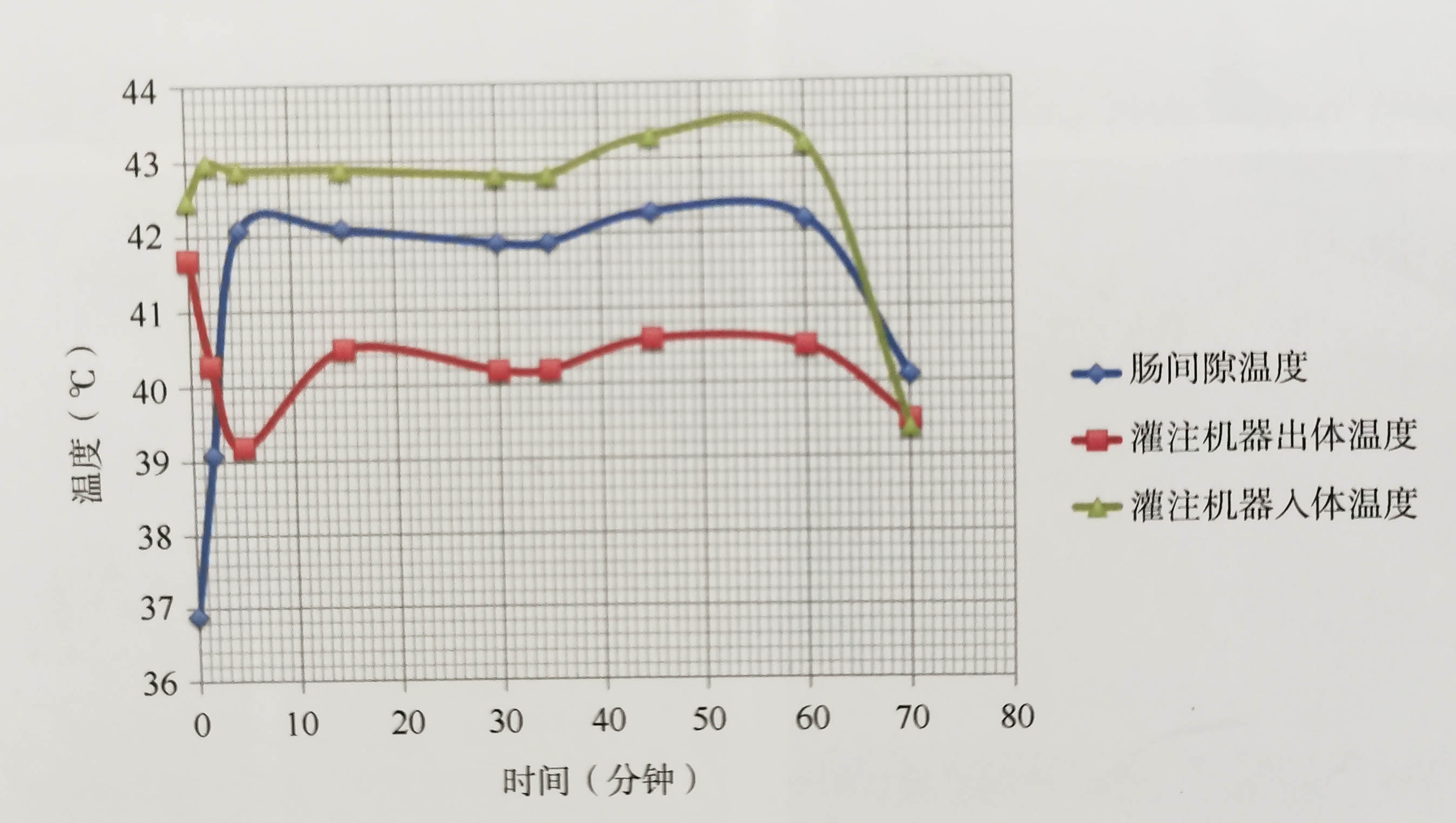
图4.7温度曲线
①心电监护的温度为“实时测量的肠间隙温度”,灌注机器上温度为“出体后到达机器时温度”;②由于出体后管路的热量散失等原因,观察到出体温度较深部肠间隙温度要低1.6~1.7℃;③灌注机器控制面板所示:“入体1”和“出体4”为管路未接入人体时的自循环温度,“入体2”和“出体5”为管路接入人体后的实际温度;④温度曲线显示:深部温度在5分钟内迅速上升至42℃,深部温度介于入体和出体温度之间,三者均保持在一个相对稳定的水平直至灌注结束;⑤灌注机器出体温 度在灌注开始后下降是由于自循环加热的液体充盈腹腔后被带走热量所致
目前笔者所在科室除将HIPEC常规应用于PMP治疗以外,已经逐渐应用到难治性腹水,以及其他来源的腹膜转移癌治疗等领域。对于有明显腹水的患者,可以在超声引导下腹腔穿刺置管行循环式的HIPEC,通常每日1次,连续行4~6次。具体置管步骤:①首先在超声引导下选取穿刺点,只要在超声下能确定肠管与腹膜没有粘连的部位均可以成为第一穿刺点;②在确定好穿刺点后测量穿刺点距离腹膜的深度和进针的方向;③体表标记穿刺点;④使用静脉穿刺套管针按预定方向与深度沿穿刺点进行腹腔穿刺,套管针穿刺能有效避免因误穿肠管而出现肠瘘的风险;⑤穿刺针穿透腹膜后有落空感,此时握住针芯直接将套管针全部送入腹腔;⑥接水试验,观察液体是否顺利输入;⑦试输500ml左右生理盐水,超声扫查初步判断所输入液体位于腹腔还是肠腔内;⑧已确定输入液体在腹腔内,此时继续向腹腔内输入生理盐水直至患者有腹胀的感觉(一般2000 ~2500ml),此时人工水腹建立成功;⑨然后在超声引导下于腹腔两对角位置确定第二、三穿刺点,作为循环灌注的出入水口,当穿刺套管有液体喷射时,说明肠管进入腹腔;⑩连接循环灌注机器,设置参数,开始治疗(图4-8)。
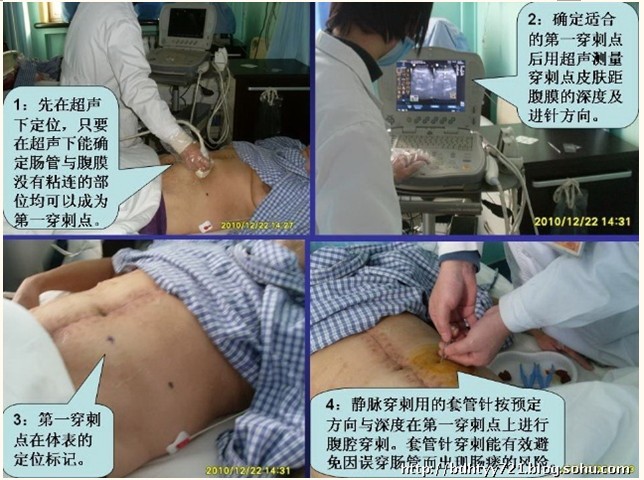
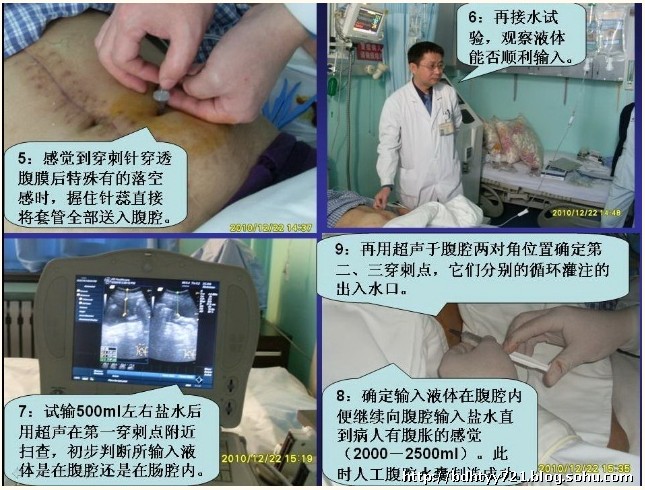
图4-8超声引导下置管建立人工水腹的步骤
对于术后出血,无法耐受循环式HIPEC及无明显腹水的患者,采用内生场热疗(非循环式腹腔深部热化疗),通常每周2次,3周为一疗程,总共6次。治疗前采用实时超声引导下建立人工水腹,首先选取肠管活动度好的区域为穿刺点;随后在超声引导下逐层斜行进针,进腹后立刻接生理盐水;在确定穿刺针在肠间隙后,注入生理盐水100~200ml;最后超声确认肠间隙增宽,放置导丝、引流管,并缝合固定(图4-9)。
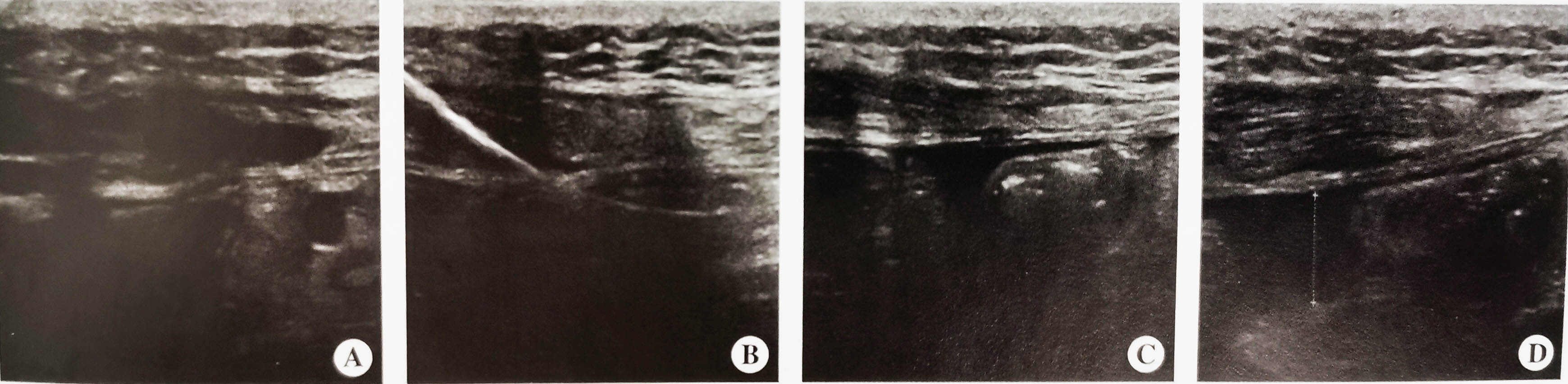
图4-9实时超声引导下人工水腹建立技术
A.选取肠管活动度好的区域为穿刺点;B.超声引导下逐层斜行进针,怀疑进腹后立刻接生理盐水;C.确定穿刺针在肠间隙后,注入100~200ml生理盐水;D.超声确认肠间隙增宽,放导丝、引流管,并缝合固定
(撰稿:蔡莺;校审:许洪斌)
参考文献
[1] Spratt JS, Adcock RA, Muskovin M, et al. clinical delivery system for intraperitoneal hyperthermic chemotherapy. Cancer Res, 1980, 40 ( 2 ) : 256-260.
[2] Blair SL, Chu DZ, Schwarz RE. Outcome of palliative operations for malignant bowel obstruction in patients with peritoneal carcinomatosis from nongynecological cancer. Ann Surg Oncol, 2001, 8 ( 8): 632-637.
[3] Sadeghi B, Arvieux C, Glehen O, et al. Peritoneal carcinomatosis from non-gynecologic malignancies: results of the EVOCAPE 1 multicentric prospective study. Cancer, 2000, 88 (2 ) : 358-363.
[4] 李雁,周云峰,梁寒,等.细胞减灭术加腹腔热灌注化疗治疗腹膜表面肿瘤的专家共识.中国肿瘤临床,2015, 42 (4): 198-205.
[5] Tabrizian P, Franssen B, Jibara G, et al. Cytoreductive surgery with or without hyperthermic intraperitoneal chemotherapy in patients with peritoneal hepatocellular carcinoma. J Surg Oncol, 2014, 110 ( 7 ) : 786-790.
[6] Golse N, Bakrin N, Passot G, et al. Iterative procedures combining cytoreductive surgery with hyperthemic intraperitoneal chemotherapy for peritoneal recurrence: postoperative and long-term results. J Surg Oncol, 2012, 106 (2 ) : 197-203.
[7] Aijona-Sanchez A, Munoz-Casares C, Ortega-Salas R, et al. Long-term survival with peritoneal mucinous carcinomatosis from intraductal mucinous papillary pancreatic carcinoma treated with complete cytoreduction and hyperthermic intraperitoneal chemotherapy. Int J Hyperthermia, 2014, 30 ( 6 ) : 408-411.
[8] 腹腔热灌注化疗技术临床应用专家协作组.腹腔热灌注化疗技术临床应用专家共识(2016版).消化肿瘤杂志,2016, 19( 3): 125-129.
[9] 崔书中,巴明臣,黄迪文,等.BR-TRG-1型体腔热灌注治疗系统的研制与开发.中国医疗设备,2009, 24 ( 9 ) : 7-9.
[10] 崔书中,巴明臣,黄迪文,等.BR-TRG-I型体腔热灌注治疗系统安全性评估的动物实验.中国比较医学杂志,2009,19( 10): 27-30.
[11] Garofalo A, Valle M, Garcia J, et al. Laparoscopic intraperitoneal hyperthermic chemotherapy for palliation of debilitating malignant ascites. Eur J Surg Oncol, 2006, 32 (6 ) : 682-685.
[12] Kusamura S, Dominique E, Baratti D, et al. Drugs, carrier solutions and temperature in hyperthermic intraperitoneal chemotherapy. J Surg Oncol, 2008, 98 (4 ) : 247-252.
[13] Zhang X, Shi H, Tang H, et al. miR-218 inhibits the invasion and migration of colon cancer cells by targeting the P13K/Akt/ mTOR signaling pathway. Int J Mol Med, 2015, 35 ( 5 ) : 1301-1308.
[14] Cui S, Ba M, Tang Y, et al. Bultrasound-guided hyperthemic intraperitoneal perfusion chemotherapy for the treatment of malignant ascites. Oncol Rep, 2012, 28 (4) : 1325-1331.
[15] Ruan Q, Fang ZY, Cui SZ, et al. Thermo-chemotherapy induced miR-218 upregulation inhibits the invasion of gastric cancervia targeting Gli2 and E-cadherin. Tumour Biol, 2015, 36 ( 8 ) : 5807-5814.
[16] 王佳泓,张相良.肿瘤细胞减灭术联合腹腔热灌注化疗治疗结直肠癌腹膜转移癌.中国肿瘤临床,2012, 39 ( 22 ) : 1694- 1695.
[17] Jacquet P, Averbach A, Stuart OA, et al. Hyperthermic intraperitoneal doxorubicin: pharmacokinetics, metabolism, and tissue distribution in a rat model. Cancer Chemother Pharmacol, 1998, 41 (2 ) : 147-154.
[18] Lu Z, Wang J, Wientjes MG, et al. Intraperitoneal therapy for peritoneal cancer. Future Oncol, 2010, 6 ( 10) : 1625-1641.
[19] Fisher B, Gunduz N, Saffer EA. Influence of the interval between primary tumor removal and chemotherapy on kinetics and growth of metastases. Cancer Res, 1983, 43 (4 ) : 1488-1492.
最新文章



